genética. La transformación genética ocurre cuando una célula capta y expresa una nueva porción de
material genético (ADN). Esta nueva información genética suele proporcionar al organismo una nueva
característica que es identificable después de la transformación. Transformación genética significa
literalmente cambio causado por genes, e implica la inserción de uno o más genes en un organismo,
con el objetivo de modificar las características de dicho organismo.
La transformación genética se usa en muchas áreas de la biotecnología.
El sistema pGLO
Con el kit de transformación pGLO, los estudiantes realizan un sencillo procedimiento para
transformar bacterias con un gen que codifica la síntesis de una proteína denominada GFP (Green
Fluorescent Protein). La fuente natural de este gen es una medusa fosforescente llamada Aequorea
victoria, en la que la GFP es la responsable de que la medusa brille o emita fluorescencia en la
oscuridad. Después de la transformación, las bacterias expresan el gen de la medusa y sintetizan la
proteína, lo que les permite emitir un color verde brillante cuando son expuestas a luz ultravioleta.
El plásmido pGLO de BioRad contiene el gen para la síntesis de la proteína GFP y un gen de
resistencia al antibiótico ampicilina. pGLO también contiene un sistema especial de regulación de
genes que se puede usar para controlar la expresión de la proteína fluorescente en las células
transformadas. El gen para sintetizar GFP se puede activar en las células transformadas simplemente
añadiendo arabinosa al medio de cultivo. La selección de las células que se han transformado con el
plásmido pGLO se realiza observando el crecimiento en placas con antibiótico. Las células
transformadas aparecerán blancas (fenotipo salvaje) en placas que no contengan arabinosa, y de color
verde fluorescente cuando se añada arabinosa al agar. La singular estructura de pGLO permite a profesores y estudiantes, por primera vez, estudiar fácilmente los mecanismos de la regulación génica
y la selección de genes. Y todo el proceso se puede observar con una simple lámpara de luz
ultravioleta.
Metodología:
– Preparación paso 1
1. Preparar el agar
Las placas se deben preparar al menos 3 días antes de realizar la práctica.
Se
deben almacenar 2 días a temperatura ambiental y luego bajo refrigeración hasta el momento de su
uso.
Para preparar el agar, añadir 500 ml de agua destilada a un matraz Erlenmeyer de 1 litro. Añadir el
contenido del paquete de agar LB. Agitar el matraz para disolver el agar, y calentar hasta ebullición en
el microondas. Volver a agitar y calentar unas tres veces más hasta que el agar se disuelva, teniendo
cuidado de dejar enfriar el matraz antes de agitarlo, para evitar que el medio caliente salte a la mano.
Cuando el agar se haya disuelto, dejarlo enfriar hasta que el matraz se pueda tocar sin quemarse (50
ºC).
Mientras se enfría el agar, etiquetar las placas y preparar la arabinosa y la ampicilina. Tener cuidado de que el agar no se enfríe tanto que llegue a solidificar.
2. Preparar la arabinosa y la ampicilina
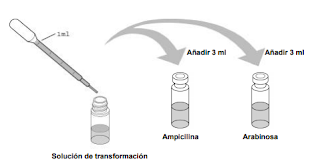 La arabinosa se encuentra deshidratada en un pequeño vial. Con una pipeta estéril, añade 3 ml de la
La arabinosa se encuentra deshidratada en un pequeño vial. Con una pipeta estéril, añade 3 ml de la
solución de transformación en el vial para rehidratar el azúcar. Agita el vial, mejor con la ayuda de un
vórtex. (Se utiliza la solución de transformación porque está estéril. En su lugar se puede utilizar agua
destilada estéril).
La ampicilina también está envasada en un pequeño vial y deshidratada. Con otra pipeta estéril,
añade 3 ml de la solución de transformación al vial para rehidratar el antibiótico (Se utiliza la solución
de transformación porque está estéril. En su lugar se puede utilizar
agua destilada estéril).
3. Rotular las placas
Las 40 placas de agar se deben rotular con un rotulador de tinta indeleble en la base, cerca del borde
de la placa.
Rotular 16 placas como LB, 16 como LB/amp y 8 como LB/amp/ara.
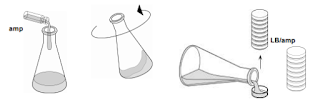
4. Añadir el agar LB en las placas
Primero, añadir el agar LB en las placas marcadas como LB.
 Hacer una torre de entre 4 y 8
Hacer una torre de entre 4 y 8
placas y con una mano abrir la tapa de la placa inferior sujetando el resto de la torre, mientras que con
la otra mano se añade el agar LB.
Rellenar la placa entre un tercio y la mitad de su capacidad (»12 ml).
Tapar esa placa, y continuar con la placa superior en la torre. Cuando se hayan rellenado todas las
placas dejarlas enfriar en esa posición.
LB
A continuación, añadir la ampicilina ya hidratada al agar LB sobrante en el matraz. Agitar el
matraz brevemente para mezclarla. Rellenar las 16 placas rotuladas como LB/amp según la técnica descrita antes.
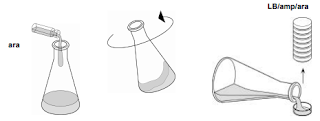
Por último, añadir la arabinosa hidratada al agar LB con ampicilina sobrante en el matraz.
Agitar el matraz brevemente para mezclarla y rellenar las 8 placas marcadas como LB/amp/ara
utilizando la técnica ya descrita.
Almacenar las placas
Después de dejar las placas dos días a temperatura ambiente se pueden utilizar o se pueden
almacenar en columnas de hasta 20 placas de altura introduciéndolas en bolsas. Guardar las placas en
la nevera de forma invertida y dentro de las bolsas hasta su uso.
– Preparación paso 2
 Con una pipeta estéril, rehidratar el liofilizado de E. coli HB101 añadiendo 250 ml de la solución de
Con una pipeta estéril, rehidratar el liofilizado de E. coli HB101 añadiendo 250 ml de la solución detransformación en el vial. Tapar el vial y dejar la suspensión 5 minutos a temperatura ambiente. Agitar
el vial antes de añadirlo a las placas de LB. (Se utiliza la solución de transformación porque está estéril.
En su lugar se puede utilizar agua destilada estéril). Guardar la bacteria rehidratada en la nevera hasta
el momento de su uso (en 24 horas a ser posible, y no más de 3 días).
colonias aisladas de la bacteria y se deben incubar a 37 ºC durante 24-36 horas antes de la
transformación.
para cada uno de los grupos de estudiantes. El propósito del aislamiento es formar colonias aisladas a
partir de una suspensión con una alta concentración bacteriana.
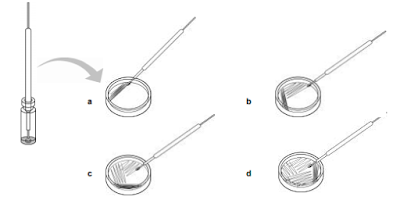
vial. Sacar el asa y extender en la placa como aparece en la figura inferior. La extensión se realiza
en cuatro cuadrantes. La primera extensión es para dispersar un poco las células. Deslizar el asa
de izquierda a derecha una docena de veces en cada uno de los cuadrantes. En cada cuadrante
consecutivo las células están cada vez más diluidas, aumentando la posibilidad de obtener
colonias aisladas.
45 grados aproximadamente (de manera que se facilite el movimiento de la mano) y comenzar con
el segundo cuadrante. Tocar el cuadrante anterior un par de veces y luego continuar deslizando el
asa de izquierda a derecha unas 10 veces.
placas de LB. Usar el mismo asa de siembra para todas las placas. Al terminar con cada placa,
taparla inmediatamente para evitar su contaminación.
durante 2-3 días si no se dispone de estufa. Usar para la transformación en las 24-36 horas
siguientes. No refrigerarlas antes de su uso.
contaminadas con otras colonias.
3. Preparar el plásmido pGLO
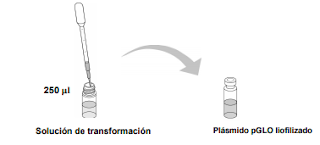 Con una nueva pipeta estéril añadir 250 ml de la solución de transformación en el vial que contiene el
Con una nueva pipeta estéril añadir 250 ml de la solución de transformación en el vial que contiene el
plásmido pGLO liofilizado. La cantidad de ADN es tan pequeña que puede parecer que el vial está
vacío. Si es posible, guardar el ADN rehidratado en la nevera (Se utiliza la solución de transformación
porque está estéril y no contienen nucleasas. En su lugar se puede utilizar agua destilada estéril).
– Preparación paso 3: Guía rápida para el uso del kit de transformación
1. Etiquetar los tubos eppendorf cerrados, uno
como +pGLO y otro como –pGLO.
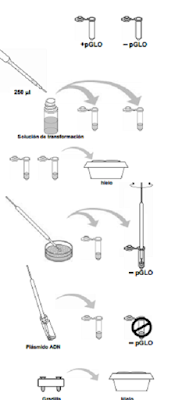 Poner los tubos
Poner los tubos
en una gradilla de corcho.
2. Abrir los tubos y con una pipeta estéril añadir
250 ml de la solución de transformación (CaCl2).
3. Poner los tubos en hielo.
4. Con un asa de siembra estéril coger una colonia
de la placa. Abrir el tubo +pGLO e introducir el
asa en la solución de transformación. Girar el
asa entre los dedos índice y pulgar hasta que la
colonia se disperse totalmente en la solución de
transformación (sin que queden fragmentos
flotantes). Dejar el tubo en la gradilla en hielo.
Con otro asa estéril repite la operación con el
tubo –pGLO.
5. Situar la solución con el plásmido pGLO a la luz
UV y anotar las observaciones. Introducir un
nuevo asa estéril en el vial que contiene el
plásmido y coger solución plasmídica (como si
cogiéramos jabón para hacer pompas de
jabón). Llevarlo al tubo +pGLO, cerrarlo y dejar
el tubo en la gradilla en el hielo. Cerrar también
el tubo –pGLO, pero sin añadir el plásmido.
¿Por qué? Plásmido ADN
6. Incubar los tubos en hielo 10 minutos.
Asegurarse de que el fondo de los tubos está
en contacto con el hielo.
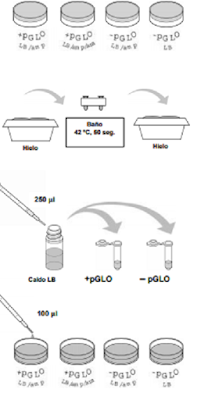 7. Mientras que los tubos permanecen en el hielo,
7. Mientras que los tubos permanecen en el hielo,
etiquetar las placas de agar en la base de la
siguiente forma: una placa LB/amp y una
LB/amp/ara como +pGLO, y otra LB/amp y otra
LB/amp/ara como –pGLO.
8. Choque térmico. Llevar los tubos en la gradilla
al baño ya preparado a 42 ºC, e introducirlos
allí durante 50 segundos exactos. Asegurarse
de colocar bien la gradilla para que el fondo de
los tubos esté en contacto con el agua.
Pasados los 50 segundos, llevar de nuevo los
tubos al hielo. El cambio de hielo al baño y
viceversa debe hacerse con rapidez. Dejar los
tubos en el hielo 2 minutos.
9. Sacar la gradilla del hielo y dejarla en la mesa.
Abre uno de los tubos, y con una nueva pipeta
estéril, añade 250 ml de caldo LB al tubo y
ciérralo. Repetir la operación con otra pipeta
estéril en el otro tubo. Incubar los tubos 10
minutos a temperatura ambiente.
Caldo LB +pGLO – pGLO
10. Agitar los tubos golpeándolos con el dedo. Con
una pipeta estéril para cada tubo, pasar 100 ml
de cada tubo a las placas correspondientes.
 11. Usando un asa de siembra estéril para cada
11. Usando un asa de siembra estéril para cada
tubo, extender el líquido por toda la superficie
de la placa, haciendo estrías en el agar en
todos las direcciones.
12. Apilar las placas y empaquetarlas con cinta
adhesiva todas juntas. Poner el nombre del
grupo e introducirlas en posición invertida en la
estufa a 37 ºC hasta el día siguiente.
Resultados
A. Recogida de resultados
Observa los resultados obtenidos tras la transformación a la luz normal de la habitación. Después sitúa
las placas bajo luz ultravioleta y observa lo que ocurre.
1. Observa atentamente y dibuja lo que ves en cada placa. Pon tus dibujos en la tabla de resultados
en la columna de la derecha. Apunta los resultados para poder comparar las observaciones de las
células +pGLO con las observaciones de las células no transformadas.
Anota las siguientes observaciones para cada placa.
2. ¿Cuánto crecimiento se observa en cada placa, a simple vista?
3. ¿De qué color son las bacterias?
4. ¿Cuántas colonias bacterianas hay en cada placa? (Cuéntalas).
Si se observa un color verde fluorescente en las colonias de E. coli, debemos plantear una nueva
pregunta:
¿Cuáles son las dos posibles fuentes de fluorescencia en las colonias cuando se exponen a
la luz ultravioleta?
Explica:
1. Recuerda qué observaste cuando iluminaste con luz ultravioleta el vial que contenía el plásmido
pGLO y anota tus observaciones.
2. ¿Cuál de las dos posibles fuentes de fluorescencia puede ser eliminada ahora?
3. ¿Qué indica esta observación sobre la fuente de fluorescencia?
4. Describe qué evidencias indican si la transformación genética se ha realizado con éxito o no.
C. Interacción entre los genes y el medio
Mira de nuevo tus cuatro placas. ¿Observas alguna colonia de E. coli en la placa LB que no
contenga ampicilina y arabinosa?
1. Basándote en tus resultados, ¿puedes decir si estas bacterias son resistentes a ampicilina
observándolas en la placa LB?
2. ¿Cómo modificarías el medio (el agar en el que están creciendo) para poder saber si son
resistentes a ampicilina?
3. Muy a menudo las características de un organismo se deben a la combinación de sus genes y del
medio.
Reflexiona sobre el color verde que viste en las bacterias transformadas:
a. ¿Qué dos factores ambientales deben estar presentes para que puedas ver el color verde? (Una
pista: un factor está en la placa y el otro en la forma cómo miras las bacterias).
b. ¿Cuál de los dos factores ambientales señalados en la pregunta anterior hacen a la bacteria
transformada que aparezca verde?
c. ¿Qué ventajas tendrá para un organismo el poder activar o desactivar determinados genes en
respuesta a diferentes condiciones?
D. Cálculo de la Tasa
de transformación
Tu próxima tarea es aprender a determinar hasta qué punto se ha producido la transformación de E.
coli, usando para ello una medida cuantitativa denominada tasa de transformación.
En muchos experimentos, es importante transformar la mayor cantidad posible de células.
La tasa de transformación se calcula para ayudar a los
científicos a determinar la eficacia del proceso de transformación.
Método: Tienes que calcular la tasa de transformación, la cual te indicará tu habilidad a la hora de introducir
moléculas de ADN en las células bacterianas.
La tasa de transformación es un número, que representa
el número total de células bacterianas que expresan la proteína GFP, entre la cantidad de ADN usada
en el experimento. Nos indica el número total de células bacterianas transformadas por microgramo de
ADN.
La tasa de transformación se calcula usando la siguiente fórmula:
Tasa de transformación = Número total de células que crecen en la placa / Cantidad de ADN (mg) en la placa
Por tanto, para poder calcular la tasa de transformación, necesitas saber:
1. El número total de colonias verde fluorescente que crecen en la placa LB/amp/ara.
2. La cantidad total de plásmido pGLO en las células bacterianas y presente en la placa
LB/amp/ara
Cálculos:
1. Determinación del número total de colonias verde fluorescente que crecen en la placa
LB/amp/ara.
Sitúa tu placa LB/amp/ara bajo luz UV.
Se supone que cada colonia de la placa procede de una
única célula, la cual, tras múltiples y sucesivas reproducciones, origina la colonia bacteriana.
La
manera más sencilla de determinar el número total de colonias verde fluorescente es contar las
colonias presentes en la placa.
Número total de células =
2. Determinación de la cantidad total de plásmido pGLO en las células bacterianas y presente
en la placa LB/amp/ara.
Para determinar la cantidad de ADN del plásmido pGLO que hay en las células
bacterianas presentes en la placa LB/amp/ara necesitamos saber: (a) La cantidad de
ADN con la que empezamos el experimento, y (b) qué fracción del ADN (en la bacteria)
realmente se añadió a las placas de LB/amp/ara.
Una vez calculado estos dos factores, tendrás que multiplicar la cantidad total de plásmido
pGLO usada en el experimento por la fracción de ADN que aparece en las placas de LB/amp/ara.
(a) Determinación de la cantidad total de plásmido pGLO
La cantidad total de ADN utilizada inicialmente es igual al producto de la concentración y el
volumen utilizados:
ADN (mg) = Concentración ADN (mg/ml) x Volumen ADN (ml)
En este experimento utilizaste 10 ml de pGLO a la concentración de 0.08 mg/ml.
Es decir, que
cada microlitro de la solución contenía 0.08 mg del ADN plásmídico pGLO.
Calcula la cantidad total de ADN utilizada:
Cantidad total de ADN (mg) =
¿Para qué te sirve este dato?
(b) Determinación de la fracción de ADN realmente transferido a la placa de LB/amp/ara.
Dado que no todo el ADN añadido al cultivo bacteriano pasa a la placa de agar, necesitas saber
cuánto ADN pasó realmente a la placa LB/amp/ara. Para calcularlo, divide el volumen de ADN
que pusiste en la placa entre el volumen total que había en el tubo que contenía el ADN.
La
fórmula a utilizar sería:
Fracción ADN utilizada = Volumen en la placa (ml) / Volumen total tubo (ml)
Pasaste 100 ml de la solución de células que contenían el ADN, de un tubo con un volumen total
de 510 ml.
¿Recuerdas por qué contenía 510 ml? Consulta el protocolo, anota los volúmenes que
añadiste en cada paso y suma las cantidades.
Usa la siguiente fórmula para calcular la fracción de ADN plasmídico pGLO que pasó a la
placa LB/amp/ara.
Fracción de ADN =
¿Para qué te sirve este dato?
Por tanto, ¿cuántos microgramos de ADN del plásmido pGLO pasaste a las placas
LB/amp/ara?
Para contestar esta pregunta, debes multiplicar la cantidad total de ADN pGLO usada por la
fracción de ADN pGLO que pasó a la placa de LB/amp/ara:
ADN pGLO transferido (mg) = cantidad total de ADN pGLO usada (mg) x fracción de ADN pGLO
ADN pGLO (mg) =
¿Qué te dice este dato? Mira todos los cálculos hechos hasta ahora, y rellena la siguiente tabla:
Ahora usa los datos de la tabla para calcular la tasa de transformación:
Tasa de transformación = Nº total de células que crecen en la placa / Cantidad de ADN (mg) en la placa
Tasa de transformación =
EN EL VÍDEO SE MUESTRAN LOS RESULTADOS OBTENIDOS